Նիտրատի և նիտրիտի հիմնական տարբերությունն այն է, որ նիտրատը պարունակում է թթվածնի երեք ատոմ, որոնք կապված են ազոտի ատոմի հետ, մինչդեռ նիտրիտը պարունակում է երկու թթվածնի ատոմ, որոնք կապված են ազոտի ատոմի հետ:
Ե՛վ նիտրատը, և՛ նիտրիտը անօրգանական անիոններ են, որոնք բաղկացած են ազոտի և թթվածնի ատոմներից:Այս երկու անիոններն էլ ունեն -1 էլեկտրական լիցք։Դրանք հիմնականում առաջանում են որպես աղի միացությունների անիոն։Կան որոշ տարբերություններ նիտրատի և նիտրիտների միջև.մենք կքննարկենք այդ տարբերությունները այս հոդվածում:
Ինչ է նիտրատը:
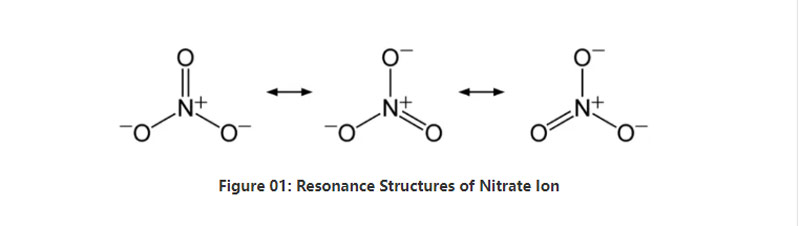
Նիտրատը անօրգանական անիոն է, որն ունի NO3– քիմիական բանաձև:Այն բազմատոմային անիոն է, որն ունի 4 ատոմ;մեկ ազոտի ատոմ և երեք թթվածնի ատոմ:Անիոնն ունի -1 ընդհանուր լիցքավորում:Այս անիոնի մոլային զանգվածը 62 գ/մոլ է։Բացի այդ, այս անիոնը ստացվում է իր զուգակցված թթվից.ազոտական թթու կամ HNO3:Այլ կերպ ասած, նիտրատը ազոտական թթվի զուգակցված հիմքն է:
Մի խոսքով, նիտրատ իոնը կենտրոնում ունի մեկ ազոտի ատոմ, որը միանում է թթվածնի երեք ատոմների հետ կովալենտային քիմիական կապի միջոցով:Այս անիոնի քիմիական կառուցվածքը դիտարկելիս այն ունի երեք նույնական NO կապեր (ըստ անիոնի ռեզոնանսային կառուցվածքների)։Այսպիսով, մոլեկուլի երկրաչափությունը եռանկյուն հարթ է:Թթվածնի յուրաքանչյուր ատոմ կրում է − 2⁄3 լիցք, որը տալիս է անիոնի ընդհանուր լիցքը որպես -1։
Ստանդարտ ճնշման և ջերմաստիճանի դեպքում այս անիոն պարունակող գրեթե բոլոր աղային միացությունները լուծվում են ջրի մեջ:Երկրի վրա մենք կարող ենք գտնել բնական նիտրատային աղեր՝ որպես նստվածքներ.նիտրատինի պաշարներ.Այն հիմնականում պարունակում է նատրիումի նիտրատ։Ավելին, նիտրացնող բակտերիաները կարող են արտադրել նիտրատ իոն:Նիտրատային աղերի հիմնական կիրառություններից մեկը պարարտանյութերի արտադրությունն է:Ավելին, այն օգտակար է որպես պայթուցիկ նյութերի օքսիդացնող նյութ:
Ինչ է նիտրիտը:
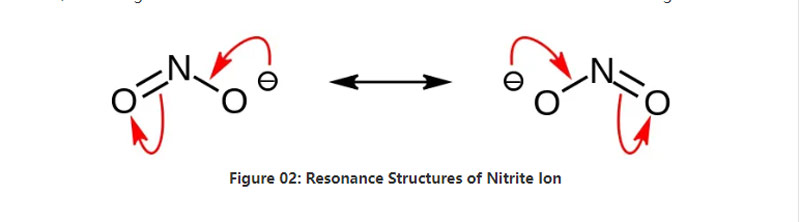
Նիտրիտը անօրգանական աղ է, որն ունի NO2– քիմիական բանաձև:Այս անիոնը սիմետրիկ անիոն է և ունի մեկ ազոտի ատոմ, որը կապված է թթվածնի երկու ատոմների հետ երկու նույնական NO կովալենտ քիմիական կապերով:Այսպիսով, ազոտի ատոմը գտնվում է մոլեկուլի կենտրոնում:Անիոնն ունի -1 ընդհանուր լիցքավորում։
Անիոնի մոլային զանգվածը 46,01 գ/մոլ է։Բացի այդ, այս անիոնը ստացվում է ազոտաթթվից կամ HNO2-ից:Հետևաբար, դա ազոտաթթվի զուգակցված հիմքն է:Հետևաբար, մենք կարող ենք արտադրել նիտրիտային աղեր արդյունաբերական եղանակով՝ ազոտային գոլորշիները նատրիումի հիդրօքսիդի ջրային լուծույթի մեջ անցկացնելու միջոցով:Ավելին, սա արտադրում է նատրիումի նիտրիտ, որը մենք կարող ենք մաքրել վերաբյուրեղացման միջոցով:Ավելին, նիտրիտային աղերը, ինչպիսիք են նատրիումի նիտրիտը, օգտակար են սննդամթերքի պահպանման համար, քանի որ այն կարող է կանխել սննդի մանրէների աճը:
Ո՞րն է տարբերությունը նիտրատի և նիտրիտի միջև:
Նիտրատը անօրգանական անիոն է, որն ունի NO3- քիմիական բանաձև, մինչդեռ նիտրիտը անօրգանական աղ է, որն ունի NO2- քիմիական բանաձև:Հետևաբար, նիտրատի և նիտրիտների միջև առաջնային տարբերությունը կայանում է երկու անիոնների քիմիական կազմի վրա:Այն է;Նիտրատի և նիտրիտի հիմնական տարբերությունն այն է, որ նիտրատը պարունակում է թթվածնի երեք ատոմ, որոնք կապված են ազոտի ատոմի հետ, մինչդեռ նիտրիտը պարունակում է երկու թթվածնի ատոմ, որոնք կապված են ազոտի ատոմի հետ:Ավելին, նիտրատ իոնը ստացվում է իր զուգակցված թթվից.ազոտական թթուն, մինչդեռ նիտրիտ իոնը ստացվում է ազոտաթթվից:Որպես նիտրատի և նիտրիտի իոնների ևս մեկ կարևոր տարբերություն, մենք կարող ենք ասել, որ նիտրատը օքսիդացնող նյութ է, քանի որ այն կարող է ենթարկվել միակ նվազմանը, մինչդեռ նիտրիտը կարող է գործել և որպես օքսիդացնող և նվազեցնող նյութ:
Հրապարակման ժամանակը` մայիս-16-2022





